폐암 표적항암제 내성과 자가포식 억제 전략


———
1. 왜 폐암 표적항암제에 ‘내성’이 생길까?
최근 폐암 치료에서 비소세포폐암(NSCLC)의 경우, Gefitinib, Erlotinib 같은 EGFR 티로신키나아제 억제제(TKI)나 Crizotinib 같은 ALK/MET 억제제가 혁신을 가져왔습니다.
하지만 일정 기간이 지나면 약제의 효과가 떨어지고, 암세포가 다시 증식하기 시작하는 내성(Resistance) 문제가 발생합니다. 이는 환자와 가족에게 큰 실망이 되기도 하고, 블로그 운영을 하시는 상상드림님께서도 정보를 공유할 때 중요하게 다루실 부분입니다.
내성이 발생하는 주요 메커니즘 중 일부는 다음과 같습니다:
- 암세포가 치료 표적 단백질의 돌연변이를 획득하거나 다른 경로(우회신호)를 활성화함 → 표적약이 더 이상 제대로 작동하지 않음
- 암세포가 약물에 의해 유도된 스트레스 상황을 견디기 위해 생존기전을 강화함
- 세포 내부에서 자가포식(autophagy) 같은 스트레스 대응 메커니즘이 활성화되어, 표적약이 유도하는 세포사멸(apoptosis)을 회피함
예컨대, Crizotinib 처리한 폐암세포에서 자가포식이 유도되고 이 자가포식 억제제가 병용되었을 때 항암제가 더 잘 작동했다는 보고가 있습니다. Oncotarget
따라서 내성을 단지 ‘새로운 약을 찾는 문제’로만 볼 게 아니라, 암세포가 어떻게 내성 생존 전략을 갖추는가를 이해하는 것이 중요합니다.
———
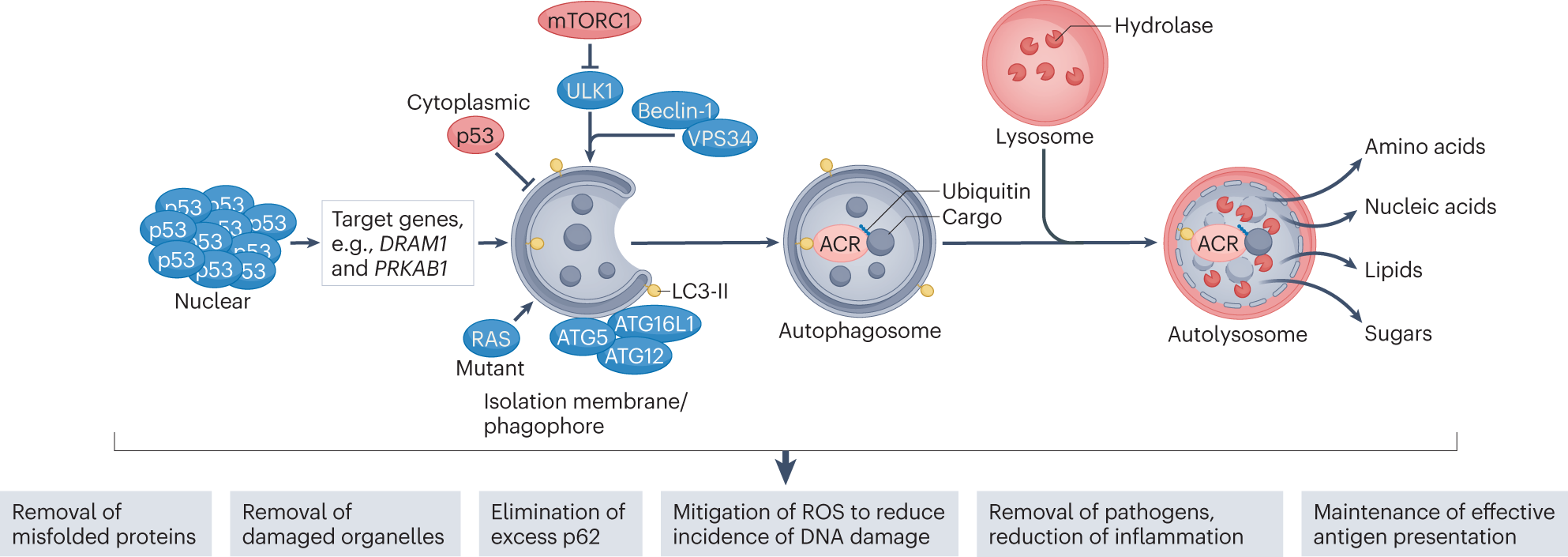
2. 자가포식(Autophagy)란 무엇인가?
자가포식은 문자 그대로 “스스로 먹는다(self-eating)”는 뜻으로, 세포가 스트레스나 영양부족 등의 조건에서 자신의 세포소기관이나 단백질을 분해해 재활용하는 생존기전입니다.
폐암을 포함한 여러 암에서는 이런 자가포식이 다음과 같이 작용합니다:
- 세포가 항암제나 방사선 등의 스트레스를 받았을 때, 자가포식을 통해 손상된 기관이나 단백질을 제거하고 에너지를 확보함 → 생존력 증가
- 반대로 자가포식이 과도하게 유도되면 세포사멸을 유도할 수 있는 이중적 역할을 가질 수 있음 PMC+1
그런데 문제는, 표적항암제를 썼을 때 암세포가 이 자가포식 경로를 생존의 도구로 전환해버릴 수 있다는 점입니다.
———
3. 폐암에서 표적항암제 내성 및 자가포식의 연결고리
폐암 치료에서 표적항암제가 효력을 잃는 과정에 자가포식이 깊이 관여한다는 연구가 증가하고 있습니다. 주요 포인트는 다음과 같습니다:
- 표적항암제 처리 시 암세포에서 자가포식이 유도되는 사례가 있습니다. 예컨대, Crizotinib가 폐암세포에서 STAT3 경로를 억제하면서 자가포식을 유도했다는 보고가 있습니다. Oncotarget
- 자가포식이 유도되면 세포사멸이 억제되고 암세포가 살아남는 비율이 올라갑니다. 위 연구에서도 자가포식 억제제를 병용했더니 항암제 반응이 개선됐습니다. Oncotarget
- 최근 리뷰에 따르면, NSCLC에서 자가포식 조절이 치료 반응과 내성 모두에 중요한 역할을 한다고 합니다. PMC+1
- 최신(2025년) 연구에서는 EGFR TKI 내성 폐암에서 자가포식 억제 가능성을 조사 중이라는 발표도 있습니다. sciencedirect.com
즉, 표적치료를 시작했을 때 잘 듣다가도 어느 시점 후에 ‘먹고살기 모드’로 전환된 암세포들이 자가포식을 써서 살아남는 전략을 펴고 있다는 겁니다.
———
4. 자가포식 억제 전략 — 내성 극복의 열쇠가 될까?
그렇다면 이 자가포식이라는 생존기전을 ‘차단’하면 내성을 극복할 수 있을까? 여러 연구가 앞으로의 가능성을 시사하고 있습니다.
자가포식 억제의 주요 접근법
- 자가포식 관련 유전자(예: ATG3, ATG5, ATG7)를 RNA 간섭(siRNA)나 유전자 조작으로 억제하는 방법. MDPI
- 자가포식 경로를 제어하는 화학적 억제제 사용: 예컨대 자가포식 초기 복합체 또는 리소좀 기능을 억제하는 약물. MDPI+1
- 표적항암제 + 자가포식 억제제 병용 치료: 암세포가 ‘살기 위한 자가포식’에 의존하고 있다면 이를 같이 막아버리면 더 효과가 있다는 개념.
폐암 적용 가능성 및 연구 근거
- 위에서 언급된 Crizotinib 연구에서는 자가포식 억제로 항암제 반응이 향상됨을 확인했습니다. Oncotarget
- 더 폭넓은 리뷰에서 “자가포식은 폐암 치료 내성에서 핵심 조절 노드”로 자리매김 중입니다. PMC
- 2025년 연구에서는 실제로 “EGFR TKI 내성폐암에서 자가포식 억제가 열쇠가 될 수 있다”는 데이터를 제시하고 있습니다. sciencedirect.com
임상적 고려사항
물론 아직 “자가포식 억제제로 폐암 내성을 완전히 해결했다”는 것은 아닙니다. 다음과 같은 고려사항이 있습니다:
- 자가포식은 정상세포에서도 중요한 생존기전이기에 과잉억제 시 부작용 가능성
- 어떤 암환자에서, 어떤 유전자 배경에서 자가포식 의존성이 높을지 선별이 중요
- 병용치료 시 안전성, 내성 악화 여부, 적정 용량 등이 아직 초기 단계
———
5. 블로그 운영자 ‘상상드림’님께 드리는 정보 공유 팁 🎯
- 제목 제안: “폐암 표적치료는 왜 잘 듣다가 멈출까? 자가포식이 내성의 열쇠다!”
- 메인 메시지는: “표적항암제가 듣다가 둔해지는 것은 암세포가 살아남기 위해 자가포식을 켜버리기 때문이다. 이 자가포식을 끄면 내성을 뚫을 수 있다”
- 그래픽 활용: 자가포식 과정(세포소기관 포식 → 리소좀 분해 → 재활용)과 표적치료 후 저항세포의 생존 전략 그림
- 실제 연구 인용: 위에 언급한 Crizotinib + 자가포식 억제 연구, 최근 2025년 논문 등을 링크해 ‘최신임’을 강조
- 독자 대상: 폐암 환자 가족, 암 치료에 관심 있는 일반인, 의료 관련 블로그 방문자 등 — 복잡한 용어는 풀어서 설명하되 전문성 잃지 않기
- 유머 포인트: 예를 들어 “암세포가 약물에 ‘오! 위험하다!’ 하고 자가포식 스위치를 켜버렸다. 그걸 다시 꺼야 한다” 같은 비유로 친근감 추가
- 향후 주제 연결: “자가포식 억제제 임상은 어디까지 왔나?”, “내성 극복 위한 병용요법 현황”, “폐암 환자 맞춤치료의 다음 단계” 등 시리즈로 이어가면 좋습니다
———
6. 결론
표적항암제가 폐암 치료에 큰 진전을 가져왔지만, 내성이라는 벽 앞에 서 있습니다. 이 벽을 허물기 위한 유망한 열쇠 중 하나가 바로 자가포식 억제 전략입니다.
암세포가 살아남기 위해 켠 ‘자가포식 생존기계’를 꺼버린다면, 다시 표적약이 힘을 발휘할 수 있는 환경이 만들어질 수 있습니다.
물론 아직 임상 적용 단계는 초기이나, 블로그에서 이런 ‘기전 중심’ 정보를 공유함으로써 환자·가족·관심자에게 희망적이고 뒷받침 있는 정보를 제공할 수 있을 겁니다.
상상드림님 블로그에 오늘도 빛나는 정보 한 조각이 되기를 바라며.....
'의학정보' 카테고리의 다른 글
| 🎈 '울고불고' 주사 굿바이? '칙칙' 코에 뿌리는 독감 백신 상륙 (7) | 2025.11.01 |
|---|---|
| 😅 임상 데이터 정리, 반려견 당뇨병 예방 팁, (3) | 2025.10.30 |
| 📌 신장 이식에 새로운 길... 혈액형 달라도 기증 가능 (0) | 2025.10.09 |
| 🔹 남성 음낭수종에대한 한방치료 요법 및 사례 (0) | 2025.10.09 |
| 🧠 통증 못 느끼는 폐, 암 진행 알아채고 빠르게 대처하려면? (0) | 2025.10.07 |